العلاج الخلوي التكيفي: CAR-T-Cell لعلاج السرطان 2022
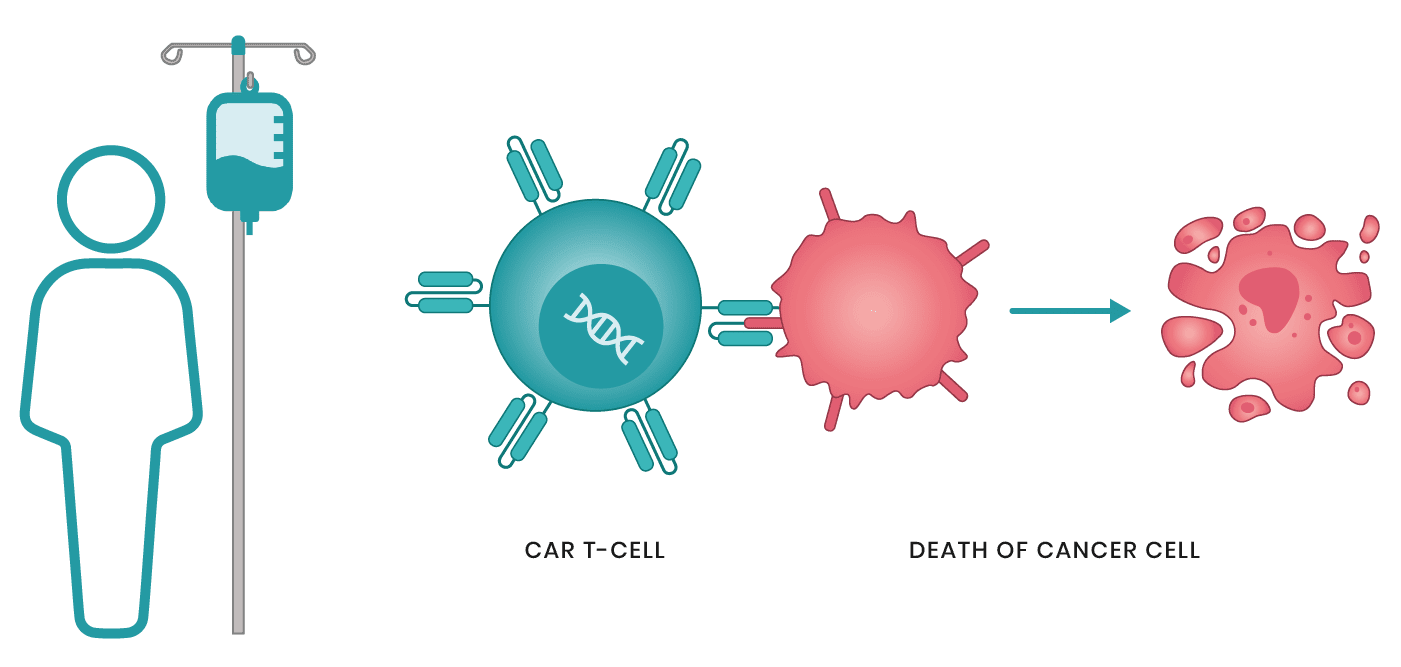
العلاج الخلوي التكيفي تم في عام 2017 الانتهاء من عدد من التجارب السريرية الكبيرة لتقنية علاج السرطان الجديدة، وهي العلاج بـ CAR T-Cell. وفقاً لنتائجهم، تمت الموافقة على اثنين من الأدوية: Kymriah و Yescarta. في الواقع يعد العلاج CAR T-Cell هو في وقت واحد علاجاً جينياً، ومناعياً، وخلوياً. تغير هذه التقنية خلايا الدم البيضاء للمريض بطريقة تمكنها من التعرف على الخلايا السرطانية وتدميرها. على الرغم من عدد من الآثار الجانبية، سيكون العلاج CAR T-Cell فعالاً بالنسبة لمعظم المرضى الذين لا يتقبلون أي علاج آخر أو في حالات الانتكاس.
المبادئ العامة لعلاج الأمراض الورمية
صاحبت أمراض الأورام البشرية عبر التاريخ، وكان قد أدخل أبقراط مصطلح “السرطان”. مع مرور الوقت، تغيرت أساليب العلاج بفضل التقدم التقني والعلمي للطب. يتم تقليدياً استخدام الطرق التالية على نطاق واسع في الممارسة السريرية:
- العلاج الجراحي، لإزالة الورم الرئيسي والانبثاث، وكذلك علاج مضاعفات المرض الأساسي
- العلاج الكيميائي، للحد من حجم الورم، والقضاء على الانبثاث ومنع الانتكاسات
- العلاج الإشعاعي، للتأثير المحلي على الورم وقمع النمو
- زراعة نخاع العظم، لاستعادة وظيفة تكون الدم عند سرطان الدم
في الوقت الحاضر، للحصول على نتائج أكثر فعالية، يتم علاج الأمراض السرطانية بشكل فردي. بالطبع، يتم اختيار جميع أنواع العلاج مع الأخذ بعين الاعتبار بخصائص الورم وحالة المريض. ومع ذلك، تتم الموافقة على بروتوكولات العلاج الكيميائي من قبل منظمات موثوقة على المستوى الدولي ولا يتم تغييرها بشكل فردي لاحتياجات كل مريض.
وعلاوة على ذلك، فإن كل طريقة من طرق العلاج لها حدودها وآثارها الجانبية وموانعها، مما لا يؤدي في النهاية دائماً إلى تحقيق هداة مستمرة للمرض.
كانت الخطوة الأولى لتطوير علاج السرطان الفردي هي العلاج المستهدف. يشمل العلاج المستهدف استخدام العقاقير أو اللقاحات، والتي يتم توجيه نشاطها إلى أنواع محددة بدقة من الخلايا السرطانية. على وجه الخصوص، أثبت نفسه في الدراسات السريرية دواء Glivec (الاسم الدولي – Imatinib) و Herceptin (الاسم الدولي – Trastuzumab). وتشمل هذه الأدوية الأجسام المضادة وحيدة النسيلة لمكونات محددة في خلايا السرطان الموجودة لدى المريض. بسبب خصوصية العمل العالية للأجسام المضادة، تهاجم المستضدات خلايا الأورام وتدمرها دون التأثير على الأنسجة والأعضاء السليمة.
العلاج المناعي
التطور الواعد الحديث في علاج السرطان – هو العلاج المناعي. يقوم الأطباء أثناء العلاج المناعي بتفعيل وضبط مناعة المريض الخاصة به، مما يعيد القدرة على محاربة المرض. لا شك أن نظام المناعة البشري لا يتوقف عن العمل عند تطور المرض الورمي. المشكلة هي أن الكريات البيض، التي تحمي الجسم من السرطان ، ليست دائماً قادرة على التعرف على الخلايا السرطانية. عند الإحياء الخبيث يتحول الورم ويفقد علاماته النموذجية ويصبح “غير مرئي” لمناعة المريض.
يتطور العلاج المناعي، أو العلاج الخلوي التكيفي، باتجاهات عديدة:
- إنشاء الخلايا الليمفاوية المؤثرة المضادة للورم (tumor infiltrating lymphocytes, TIL). تكتسب الخلايا الليمفاوية المتغيرة القدرة على التعرف على الورم، وتخترق الأنسجة الخبيثة ويكون لها تأثير مباشر سام للخلايا. وهذا يعني أن الخلايا الليمفاوية المؤثرة المضادة للورم تقتل الورم حرفياً.
- إنشاء مستقبلات محددة لخلايا-T (أي T-cell receptors, TCR). يتم معالجة الخلايا الليمفاوية للمريض بمواد مشابهة في بنيتها لخلايا الورم. في الوقت نفسه، يظهر عدد كبير من المستقبلات الخاصة على سطح الخلايا الليمفاوية، والتي يمكنها العثور بسهولة على خلايا ورمية مماثلة في الجسم.
- إنشاء الخلايا الليمفاوية مع مستقبلات المستضدات الخيمرية (chimeric antigen receptor, CAR). في هذه الحالة، بمساعدة تقنيات الهندسة الوراثية، يتم إنشاء مستقبلات خاصة تتطابق بشكل مثالي مع الخلايا السرطانية للمريض. بعد ذلك، يتم وضع المستقبلات على الخلايا الليمفاوية للمريض، والتي تبدأ في التكاثر بنشاط والقتال مع نسيج الورم.
يسمى العلاج الخلوي التكيفي بـ “الطب الحي”. تم بناء هذا النوع من العلاج المناعي بطريقة تمكن خلاياها من التعامل مع المرض. في نفس الوقت، يتم تكوين مناعة طبيعية مستقرة ولا يتكرر المرض في المستقبل – هذا أمر ذو أهمية كبيرة لجميع أمراض الأورام.
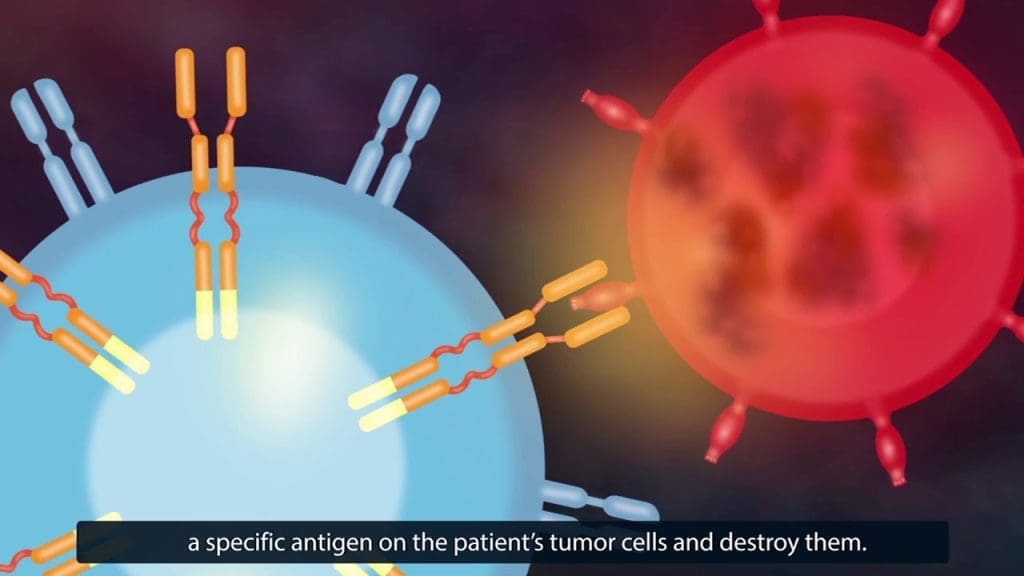
ما هو الـ CAR؟
CAR – جزيئات صناعية مصممة بعناية لا توجد في البيئة الطبيعية. الغرض من إنشاء CAR هو مهاجمة الجزيئات المستهدفة الخاصة على سطح الخلايا السرطانية. هم عادة المستضدات CD19 و CD22، وهي مخصصة للخلايا الخبيثة في سرطان الدم. من المهم للغاية عدم وجود جزيئات مماثلة على سطح الخلايا السليمة. في تلك الحالة ستخضع الخلايا السليمة أيضاً للهجوم، مما يقلل من تأثير العلاج.
لدى الجزيء CAR بنية معقدة. كل جزء من المستقبلات الخيمرية، أو كل دومين، له أهميته في تحقيق النتيجة النهائية – تدمير الخلايا السرطانية.
يتكون CAR من الأجزاء التالية، بدءاً من السطح:
دومين التعرف على المستضد، والدومين المستهدف ((antigen recognition [targeting] domain). مهمة هذا الجزء من CAR هو البحث عن الخلية السرطانية وتحديدها بدقة. من الناحية المجازية، يطابق مستقبل CAR الجزيئات الموجودة على سطح الخلية السرطانية كما يطابق المفتاح القفل. إذا كان مثل هذا “المفتاح” مفقودًا، تتوقف الخلايا المناعية عن رؤية الخلايا السرطانية. هذا يسمح لعملية الأورام بالتقدم دون حسيب أو رقيب.
- في الممارسة السريرية، يتم تطبيق CAR على المستضدات CD19 و CD22. لمزيد من الدقة في العلاج، يتم إنشاء CAR التي يمكنها التعرف على العديد من المستضدات في نفس الوقت.
- منطقة المفصلات المرنة. يوفر هذا الجزء من CAR إمكانية تنقل المستقبل، وتسمح لها بالبحث عن الخلايا السرطانية بشكل أكثر فعالية.
- دومين عبر الغشاء. في هذا الجزء من CAR، يتم تثبيت المستقبلات الخيميرية في الخلايا الليمفاوية للمريض.
- داخل الدومين الغشائي. يقع هذا الجزء من CAR مباشرة داخل اللمفاويات، مما يوفر العمل عند الاتصال مع الخلية السرطانية. يتكون الدومين الغشائي من عدة كتل:
- الدومين المنشط المؤشر. يبدأ هذا الدومين بالعمل عند تواصل الخلية اللمفاوية التي تحتوي على CAR مع خلية ورمية. إنه يحفز تركيب المواد السامة للخلايا السرطانية، وكذلك يحفز انتشار الخلايا الليمفاوية.
- الدومين المنشط المشارك. هذا الدومين موجود في CAR من الجيل الثاني. بفضل الدومين المنشط المشارك، يحدث تنشيط إضافي لعمل الخلايا الليمفاوية، ويطول عمرها في دم المريض. يحتوي الجيل الثالث من CAR على تشكيلة من أكثر من دومينين محفزين مشتركين.
بسبب التركيبة المعقدة، تقوم الكريات البيض المنشطة بـ CAR بتدمير الخلايا السرطانية من خلال عدة آليات:
- نشر المواد السامة للخلايا في الدم، الـ perforin و الـ granzyme. المواد السامة للخلايا لها تأثير مباشر على الخلايا السرطانية، مما يؤدي إلى موتها.
- توليف السيتوكينات وعوامل النسخ. هذه المواد تخلق ظروف مواتية لتكاثر وعيش الكريات البيض، وتسمح للكريات البيض بالبقاء في الدم لفترة أطول والتأثير على الورم.
نطاق العلاج الخلوي CAR-T
نشأت فكرة العلاج بـ CAR-cell في البداية في إسرائيل، في عام 1989. أجريت أول دراسة للاستخدام السريري لـ CAR في عام 1996 على المرضى الذين يعانون من سرطان المبيض. لم تكن النتائج واعدة، ولكن منذ ذلك الحين قطع أسلوب العلاج الخلوي CAR-T شوطاً طويلاً في التحسين.
كانت فترة الدراسة الفعالة للعلاج الخلوي CAR-T في التجارب السريرية العشوائية في 2015-2017. ونظراً لخصائص جزيئات CAR، تم استخدام هذه التقنية في الدراسات الصغيرة التي شملت البالغين والأطفال. وبالنتيجة، تم الحصول على أفضل النتائج في علاج سرطان الدم الليمفاوي الحاد لدى الأطفال، وكذلك الأورام اللمفاوية لا هودجكين لدى البالغين. وفي الوقت نفسه، تم إجراء العلاج بالخلايا CAR-Т للمرضى الذين يعانون من مراحل متقدمة من المرض – في حالة عدم تأثير نوعين أو أكثر من العلاج السابق أو عند تطور الانتكاس. واستناداً إلى
في عام 2017، تمت الموافقة على عقارين رسمياً، هما Kymriah و Yescarta. واستناداً إلى نتائج الدراسات، ثبت أن العلاج الخلوي CAR-T يقتل الخلايا السرطانية وسلائفها بشكل فعال.
المجال الآخر الواعد للعلاج الخلوي CAR-T هو علاج الورم النقوي المتعدد. لإجراء تجارب سريرية، يتم إنشاء CAR جديدة ضد مستضد BCMA (أي B-cell maturity antigen)، والذي يظهر على خلايا السرطان الناضجة. هذا الدواء قيد التطوير حالياً في جامعة بنسلفانيا بمشاركة شركة Novartis.
وسوف ينظر العلماء في المستقبل في استخدام العلاج الخلوي CAR-T لعلاج الأورام الصلبة أي الأورام من الخلايا الظهارية منخفضة الدرجة (على وجه الخصوص، سرطان الثدي وسرطان الأمعاء). تتمثل الصعوبة في خلق أورام خاصة بـ CAR في الطفرة المستمرة للخلايا الخبيثة وعدم تناسق تركيب المستضدات السطحية (الجزيئات التي تتعرف على الخلايا الليمفاوية مع CAR).
مخطط العلاج الخلوي CAR-T
يستخدم العلاج الخلوي CAR-T الكريات البيض الخاصة بالمريض لمكافحة الخلايا السرطانية. وفقاً لذلك، فإن المرحلة الأولى من العلاج تتمثل في الحصول على الكريات البيض للمريض – وهذا يحدث أثناء أخذ عينات الدم خارج الجسم وفصادة الكريات البيض (الحصول المباشر على الكريات البيض من الدم). بالإضافة إلى جمع الكريات البيض، فإن تكوينها النوعي مهم. وعلى وجه الخصوص، تتم إزالة الوحيدات من العدد الكلي للكريات البيض، والتي تعوق في البيئة الطبيعية تنشيط وتكاثر الخلايا التائية اللازمة للعلاج العلاج الخلوي CAR-T.
يتم إدخال مناطق جديدة في الشفرة الوراثية للكريات البيض المختارة، والتي ستوفر لاحقاً ظهور CAR المحددة على سطح الخلايا. يتم نقل المادة الوراثية الجديدة إلى الحمض النووي للكريات البيض بمساعدة فيروس متعادل أو ينقول (وهو جزيء DNA يمكن أن ينتقل بين الجينوم)، وهذه التقنية لا تشكل خطر العدوى على مريض.
بعد تلقي كريات البيض المحدثة التي تحتوي على CAR، يتم تكاثر الخلايا في المختبر. يعد إدخال عدد كاف من الكريات البيض النشطة مع CAR شرطاً أساسياً للعلاج الفعال. هذه المرحلة المختبرية هي الأكثر استهلاكاً للوقت ويمكن أن تستغرق ما يصل إلى 22 يوماً.
لتوفير الوقت، اقترح بديل يتجلى في استخدام الكريات البيض من متبرعين. وهذا من شأنه أن يسمح بإعداد اللقاح المطلوب مقدماً. بالإضافة إلى ذلك، يمكن ذلك من تجنب صدمة إجراء أخذ العينات لدى المريض المصاب بسرطان الدم. تم تنفيذ العمل في هذا الاتجاه من قبل شركة Cellectis، بمشاركة شركتي Servier و Pfizer. للأسف، لم يتم قبول الدواء UCART19 لاستخدامه، الذي تم إنشاؤه على أساس الكريات البيض المانحة، بسبب ارتفاع معدل الوفيات بين المرضى.
قبل إعادة إدخال الكريات البيض المحتوية على CAR يتم إعطاء المريض دورة من العلاج الكيميائي تهدف إلى تقليل عدد الكريات البيض الخاصة بهم. تسمح هذه الظروف بتضاعف الكريات البيض “الخاصة” التي يتم إدخالها بشكل مكثف أكثر. عند تنفيذ العلاج الخلوي CAR-T، فإن دورة واحدة فقط من معالجة جينوم الكريات البيض تكون كافية. في المستقبل تتكاثر خلايا الدم البيضاء بنفسها في دم المريض، مما يوفر مناعة دائمة ضد الانتكاس.
العقاقير المعترف بها للعلاج الخلوي CAR-T
في عام 2017، وافقت إدارة الغذاء والدواء الأمريكية (Food and Drug Administration, FDA) على عقارين للعلاج الخلوي CAR-T على أساس التجارب السريرية.
أول عقار تمت الموافقة على استخدامه في 30 أغسطس 2017، كان Kymriah (الاسم الدولي – tisagenlecleucel) لشركة Novartis. إن Kymriah فعال لعلاج سرطان الدم الليمفاوي الحاد B الخلية (ALL) لدى الأطفال والبالغين الذين تقل أعمارهم عن 25 سنة. ولذلك أهمية خاصة في علاج المرضى البالغين، حيث أن البقاء على قيد الحياة لمدة 5 سنوات عند الإصابة بـ ALL لدى الأطفال هو 90 ٪. وفقاً لنتائج الدراسة السريرية لـ ELIANA، عند العلاج باستخدام هذا الدواء، يحقق 83٪ من المرضى الهداة.
من الجدير بالذكر أنه يوصى بالعلاج بـ Kymriah لأولئك المرضى الذين لم يستجيبوا للعديد من العلاجات، بما في ذلك زراعة نخاع العظم الغير ناجح. كما أن انتكاس المرض لا يعد أيضاً عقبة أمام استخدام Kymriah.
العقبة التي تحول دون استخدام Kymriah على نطاق واسع هو ارتفاع تكلفة العلاج. إن سعر إنشاء وإدخال الدواء، دون الأخذ بعين الاعتبار بتكلفة البقاء في المستشفى، يصل إلى 475000 دولار. للوهلة الأولى، هذه الكمية كبيرة جداً، ولكنها أقل بكثير من تكلفة زراعة نخاع العظم والأدوية التي سيتوجب استخدامها على مدى الحياة. بالإضافة إلى ذلك، يعد مصنعو الأدوية بتقديم العلاج مجاناً للمرضى إن لم يتلقوا فائدة كبيرة منه خلال الشهر الأول.
على الرغم من الموافقة لاستخدام الدواء في الطب العملي، تستمر دراسة آثاره. يمر Kymriah الآن بمرحلة الدراسات الرصدية بعد التسويق.
الدواء الثاني المعتمد للعلاج الخلوي CAR-T في 18 أكتوبر 2017، كان Yescarta (الاسم الدولي – axicabtagene ciloleucel) لشركة Kite Pharma Inc. يستخدم Yescarta لعلاج المراحل المتأخرة من الأورام اللمفاوية لا هودجكن لدى البالغين.
وكما هو الحال مع Kymriah، يوصف Yescarta للمرضى الذين يعانون من عدم الاستجابة للعلاج أو الانتكاس بعد استخدام ما لا يقل عن نوعين من العلاج. القيد الوحيد الذي يمنع استخدام الدواء هو إصابة الضرر الأساسي لورم الغدد اللمفاوية في الدماغ أو الحبل الشوكي.
فيما يتعلق بالفعالية، فقد أظهرت دراسة أجريت على 100 مريض يعانون من ورم الغدد الليمفاوية B-cell المقاوم للعلاج أو المتكرر أن العلاج حقق هداة كاملة لدى 51٪ من المرضى بعد جرعة واحدة من الدواء. لدى 72٪ من المرضى، لوحظ وجود ردة فعل إيجابية للدواء.
تصل تكلفة دورة العلاج الخلوي CAR-T بـ Yescarta إلى 373000 دولار. يبحث المصنعون عن طرق لخفض تكلفة مراحل إنتاج الدواء، مما سيجعل العلاج بأسعار معقولة أكثر للمريض العادي.
الآثار الجانبية للعلاج الخلوي CAR-T
يعطي العلاج الخلوي CAR-T فرصة للخلايا المناعية الخاصة بالمريض برؤية خلايا الورم وتدميرها. وفي الوقت نفسه، فإن التحفيز القوي للمناعة يؤثر حتماً على الجسم ككل ويؤدي غالباً إلى حدوث آثار جانبية خطيرة. تخضع المرافق الطبية التي يتم فيها إجراء العلاج الخلوي CAR-T لفحص للحصول على شهادة خاصة. قبل البدء بالعلاج، يتم إخبار المرضى بالتفصيل عن الآثار الجانبية المحتملة حتى تكون لديهم الفرصة لتقييم جميع مخاطر العلاج.
تتطور ردود الفعل السلبية للأدوية في غضون 1-22 يوم بعد النقل. وتشمل ردود الفعل السلبية:
- انخفاض في عدد الكريات البيض، وضعف نظام المناعة، وتطور الأمراض المعدية
- فقر الدم، انخفاض ضغط الدم الشرياني
- في حالات نادرة – الفشل الكلوي الحاد
- أعراض عصبية، في الحالات الشديدة – وذمة دماغية
التفاعل السلبي الأكثر شيوعاً الذي يتطور لدى 70-75٪ من المرضى هو متلازمة إفراز السيتوكين أو متلازمة “هجوم السيتوكين”. السيتوكينات هي جزيئات بروتينية صغيرة تضمن، في الظروف العادية، عمل الجهاز المناعي. عند اتصال الخلايا التائية CAR مع الورم، يتم إفراز عدد كبير من السيتوكينات في الدم. في هذه الحالة، يعاني المريض من ضعف، وارتفاع في درجة حرارة الجسم، والقيء، والإسهال. إذا لم يكن بالإمكان التغلب على هذه الأعراض لفترة طويلة، يظهر هناك خطر على الحياة.
الطريقة الأكثر فعالية لمواجهة متلازمة إفراز السيتوكينات هي استخدام الأدوية الحاصرة. تشمل هذه الأدوية على وجه الخصوص Actemra (الاسم الدولي – tocilizumab)، والذي يمنع تأثير إنترلوكين 6. كما أن الأدوية التقليدية غير الستيرويدية المضادة للالتهابات فعالة أيضاً (على سبيل المثال، ديكلوفيناك).
آفاق العلاج الخلوي CAR-T في المستقبل
يعد العلاج بالخلايا التائية CAR أسلوباً جديداً يتطلب فترة طويلة من الدراسة الإضافية. تجرى حالياً أكثر من 200 دراسة سريرية، تطرح خلالها أسئلة مختلفة.
الأكثر موضوعية منها هي ما يلي:
- إنشاء خلايا CAR-T لأنواع مختلفة من السرطان، بما في ذلك للأورام الصلبة؛
- خلق خلايا CAR-T داخل الجسم، دون ضرورة أخذ الكريات البيض من الدم ومعالجتها الطويلة؛
- خلق خلايا CAR-T يمكن السيطرة عليها، والتي سيكون من الممكن توقيف كثافة عملها للحد من إفراز السيتوكينات وتسهيل متلازمة “هجوم السيتوكين”.
الأسئلة الشائعه
العلاج في تركيا:
يمكن أن يقدم الطاقم الطبي من فرق الجراحة والأطباء والمستشارين في ريهاب تورك أفضل خيارات العلاج والاستشارات المجانية – وذلك عبر سعيهم الدؤوب لمواكبة أحدث التقنيات والأساليب الطبية.
اقراء أيضا…..
